Schon den griechischen Naturphilosophen war bekannt, dass die Materie aus kleinen, auch chemisch unteilbaren Teilchen bestehen musste. Sie nannten diese Teilchen Atome.
Elektrische Erscheinungen spielten bei diesem Modell noch keine Rolle, obwohl auch diese schon sehr früh bekannt waren. Man wusste, dass die elektrische Ladung etwas Stoffliches sein musste, das von einem Körper auf einen anderen übertragen werden konnte.
Erst zu Beginn des 20. Jahrhunderts wurden die elektrischen Erscheinungen in das Atommo-dell mit einbezogen: In einer gleichmässig mit positiver Ladung erfüllten Kugel sollten negativ geladene Teilchen (Elektronen) schwingungsfähig eingebettet sein (Thomson- oder Rosi-nenteig-Modell).
Doch schon bald stellte man in Versuchen fest, dass die Masse der Atome nicht gleichmässig verteilt sein konnte, sondern nur in einem kleinen Teil derselben konzentriert sein musste.
Rutherford stellte planmässige Versuche darüber an, wie sich Teilchen beim Durchgang durch Materie verhalten. Dabei nutzte er die neu entdeckte Radioaktivität von gewissen Stof-fen aus, die ihm als Quelle für die benötigte Teilchenstrahlung diente.
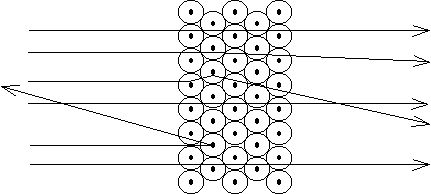
Eine dünne Goldfolie, die etwa 2000 Atomlagen enthielt, wurde mit positiven Teilchen durch-strahlt (a-Strahlung). Mit einem Zinksulfidschirm wurden Ort und Anzahl der durchdringenden Teilchen beobachtet.

Die meisten Teilchen durchdrangen das Metall unter keiner oder nur geringer Ablenkung. Wenige wurden stark abgelenkt und nur einzelne wurden reflektiert.
Die Atome müsen im Prinzip "leer" sein. Die starke Ablenkung einzelner Teilchen wird durch positive Zentren im Atom bewirkt, die sehr weit auseinander liegen müssen und praktisch die ganze Masse des Atoms in sich vereinigen.
Das Atom besteht aus einem Kern und einer Hülle.
Masse |
Ladung |
Grösse |
|
Kern |
99,95% |
positiv |
10-13 cm |
Hülle |
0,05% |
negativ |
10-9cm |
Kern und Hülle sind aus weiteren, noch kleineren Teilchen aufgebaut. Die Elektronen sind als Träger der negativen Ladung in der Hülle anzutreffen. Sie sind in ständiger Bewegung um den Kern. Diese Bewegung ist nötig, damit die Elektronen nicht in den positiv geladenen Kern fallen.
Weil die Atome nach aussen hin neutral sind, müssen im Kern ebenso viele positive Ladungs-träger sein, die Protonen.
Lauter gleiche Ladungen im Kern würden sich abstossen. Deshalb sind im Kern nebst den Protonen noch eine Anzahl neutraler Teilchen, die Neutronen, die den Zusammenhalt im Kern bewirken.
Protonen und Neutronen sind die Träger der Kernmasse.
Teilchenart |
Ort |
Masse in g |
Ladung in C |
Proton |
Kern |
1,67·10-24 |
+1,60·10-19 |
Neutron |
Kern |
1,67·10-24 |
0 |
Elektron |
Hülle |
9,11·10-28 |
+1,60·10-19 |
Für die kleinen atomaren Grössen hat man spezielle atomare Masseinheiten festgelegt: die Atomare Masseneinheit 1u und die Elementarladung 1e.
Die atomare Masseneinheit 1 u beträgt 1/12 der Masse eines Kohlenstoffatoms.
Die Elementarladung 1 e ist die Ladung eines Elektrons oder Protons.
Mit diesen Masseinheiten ergeben sich für die Eigenschaften der Elementarteilchen folgende gerundete Werte:
Teilchenart |
Symbol |
Masse in u |
Ladung in e |
Proton |
p+ |
1 |
+11 |
Neutron |
n |
1 |
0 |
Elektron |
e- |
0,0005 |
-1 |
Die chemischen Eigenschaften der Elemente werden durch die Elektronenhülle bestimmt, wobei die Zahl der Elektronen gleich der Zahl der Protonen ist. Die Neutronen haben diesbe-züglich keinen Einfluss.
Zwei Atome mit gleicher Protonenzahl gehören somit immer zum gleichen Element, auch wenn sie verschiedene Neutronenzahlen haben. Sie haben gleiche chemische Eigenschaften und unterscheiden sich nur in ihren Massen und einigen physikalischen Eigenschaften.
Atome des gleichen Elements, d.h. mit gleicher Protonenzahl, aber verschiedener Neutronenzahl, heissen Isotope.
besitzen keine Isotopen (Na, Al, P, F, Be, Mn)
Gemisch von Isotopen (H, C, O, Cl, Zn)
Atome, die eine gleiche Anzahl Neutronen, aber verschieden viele Protonen haben, bezeich-net man als Isotone.
Atome, die eine gleiche Massenzahl haben, sich aber in der Protonenzahl unterscheiden, nennt man Isobare.
 |
Massenzahl = Protonenzahl + Neutronenzahl |
Neutronenzahl = Massenzahl - Ordnungszahl |
|
p+ |
n |
e- |
p+ |
n |
e- |
||
|
12 |
12 |
12 |
|
17 |
18 |
17 |
|
16 |
18 |
16 |
|
18 |
22 |
18 |
|
54 |
77 |
54 |
|
12 |
13 |
12 |
|
20 |
20 |
20 |
|
18 |
18 |
18 |
|
13 |
14 |
13 |
|
19 |
21 |
19 |
Isotope: |
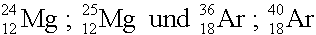 |
Isobare: |
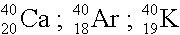 |
Isotone: |
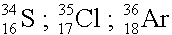 |
Isotopen lassen sich am besten mit dem Massenspektrografen untersuchen. Dieses Gerät trennt Ionen nach ihrem Verhältnis von Ladung zu Masse. Besteht ein Element aus verschie-denen Atomsorten, die sich in der Masse unterscheiden, dann haben Ionen dieses Elements verschiedene e/m-Verhältnisse.
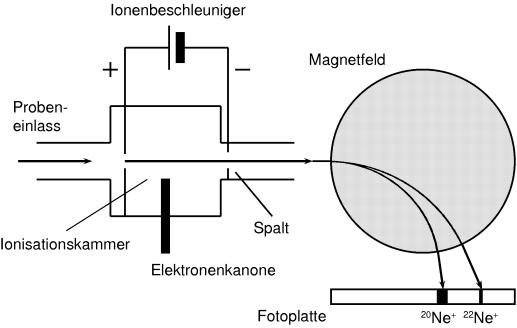
Die Atome der Probe bekommen durch den Beschuss mit Elektronen eine elektrische La-dung, sie werden ionisiert. Die entstandenen Ionen werden in einem elektrischen Feld beschleunigt und dann durch ein Magnetfeld geführt. Durch das magnetische Feld werden die Ionen auf eine Kreisbahn gezwungen, deren Radius vom Verhältnis von Ladung zu Masse des Ions bestimmt ist. Teilchen mit gleichem Verhältnis treffen auf einer Fotoplatte an der gleichen Stelle auf. Die Ionen der Isotopen haben zwar die gleiche Ladung, aber verschiedene Massen. Es entstehen daher den verschiedenen Massen entsprechende Linien, ein Massenspektrum.
Neon ist demnach ein Isotopengemisch, das im wesentlichen aus 91% 20Ne und 8,8% 22Ne besteht. Es besitzt die durchschnittliche Atommasse 20,183 u.
Weitere Isotopengemische:
Wasserstoff |
1H 99,985 % ; 2H 0,015 % |
Chlor |
35Cl 75,4 % ; 37Cl 24,6 % |
Uran |
234U 0,006% ; 235U 0,72% ; 238U 99,27% |
Atomkerne sind nur innerhalb eines bestimmten Verhältnisses von Neutronen und Protonen stabil.
Auch Kerne mit einer Masse von über cà. 250 u und energetisch angeregte Kerne sind nicht mehr beständig.
Die Kerne (Nuklide) zerfallen mehr oder weniger schnell unter Aussendung von Teilchen oder Energie in Form einer Strahlung, sie sind radioaktiv.
Unter Radioaktivität versteht man den natürlichen oder erzwungenen Zerfall von Atomkernen unter Aussendung von Teilchen- und Energiestrahlung.
Beim radioaktiven Zerfall entstehen neue, unter Umständen wiederum radioaktive Stoffe.
Der radioaktive Zerfall läuft von selbst ab und lässt sich nicht stoppen. Er ist unabhängig von Druck, Temperatur und chemischer Umgebung !
Kennzeichnende Grössen für den radioaktiven Zerfall eines Nuklids sind die Aktivität A und die Halbwertzeit T.
Die Aktivität A ist das Verhältnis aus der Anzahl Zerfälle eines Präparates und der Zeit.
Masseinheit: 1 Bq (Becquerel) = 1 Zerfall/s
Die Aktivität einer Substanz nimmt mit der Zeit exponentiell ab.
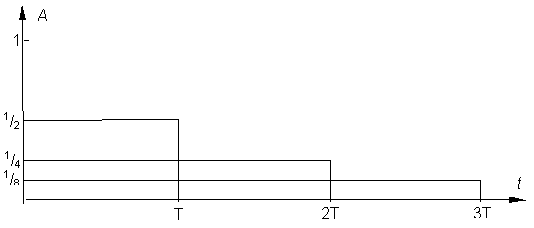
Die Halbwertzeit gibt an, in welcher Zeit sich die Anfangsaktivität auf 50% verringert hat.
Die Halbwertzeit ist ein statistischer Wert über eine sehr grosse Anzahl von Kernen. Vom einzelnen Kern kann man nicht sagen, ob er sofort oder erst nach unabsehbarer Zeit zerfällt.
Beispiele von radioaktiven Atomkernen mit ihren Halbwertzeiten:
137Cs |
T = 30 a |
24Na |
T = 15 h |
131I |
T = 8,1 d |
214Po |
T = 0,15 ms |
Kerne mit einem ungünstigen Protonen-Neutronen-Verhältnis und Kerne mit zu hoher Masse stabilisieren sich durch Kernumwandlungen. Je nach Ursache ihrer Instabilität resultieren daraus verschiedene Zerfallsarten:
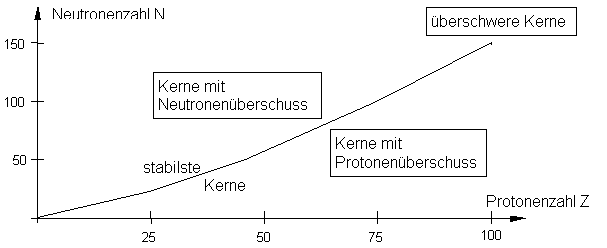
Zerfallsart |
DN |
DZ |
DM |
|
überschwere Kerne |
a-Zerfall |
-2 |
-2 |
-4 |
Neutronenüberschuss |
b--Zerfall |
-1 |
+1 |
0 |
Protonenüberschuss |
b+-Zerfall |
+1 |
-1 |
-0 |
Da die Produkte eines radioaktiven Zerfalls oft auch radioaktiv sind, bilden sich eigentliche Zerfallsreihen.
Beispiel:
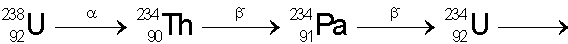
Neben den drei natürlichen Zerfallsarten gibt es noch künstliche, die durch den Beschuss von Kernen mit z.B. Heliumkernen hervorgerufen werden.
Protonen-Zerfall
Heliumkerne werden in die Kerne eingebaut unter Aussendung eines Protons.
Neutronen-Zerfall
Ein Neutron wird aus dem Kern geschlagen oder er zerfällt in Bruchstücke unter Aussendung von Neutronen (Kernkraftwerk).
Das Aussenden energiereicher Teilchen oder elektromagnetischer Wellen im Zusammenhang mit radioaktiven Zerfällen nennt man radioaktive Strahlung.
Von den heute bekannten Strahlungsarten sind aus den natürlichen Zerfallsarten die a-, die b- und die g-Strahlung sowie die künstliche Neutronenstrahlung und die kosmische Strahlung von Bedeutung.
Alle Strahlungsarten treten selten alleine auf.
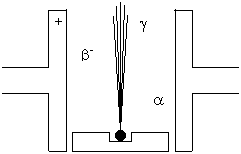
Überschwere Kerne senden beim a-Zerfall sog. a-Teilchen aus. Das sind zweifach positiv geladene Heliumkerne.
Ihre Gschwindigkeit ist etwa 104 km/s. Wegen ihrer verhältnismässig grossen Masse haben sie eine grosse Energie. Als energiereiche, geladene Teilchen besitzen sie eine starke ioni-sierende Wirkung aber nur eine kleine Reichweite (in Luft cà. 1,6 cm).
Kerne mit Neutronenüberschuss wandeln Neutronen unter Aussendung eines Elektrons in Protonen um: b--Strahlung.
Kerne mit Neutronenmangel wandeln Protonen unter Aussendung eines Positrons (ein mit dem Elektron vergleichbares Teilchen mit positiver Ladung) in Neutronen um: b+-Strahlung.
Ein b-Teilchen verlässt den Kern mit nahezu Lichtgeschwindigkeit. Mit seiner viel kleineren Masse ergibt sich aber nur ein etwa halb so grosser Energieinhalt gegenüber der a-Strahlung. Damit hat ein b-Teilchen eine weniger stark ionisierende Wirkung, dafür aber eine grössere Reichweite.
Befindet sich ein Kern in angeregtem Zustand (erhöhter Energieinhalt aus einem Stoss oder als Restenergie eines früheren Zerfalls), so kann er durch Aussendung einer elektromagnetischen Welle (g-Strahlung) in einen tieferen Energiezustand übergehen. Die g-Strahlung tritt deshalb vorwiegend als Begleitstrahlung auf.
Sie hat eine Wellenlänge im Bereich von 1 pm und eine nochmals um etwa die Hälfte kleinere Energie als die Betastrahlung. Sie gehört aber zu den energiereichsten elektromagnetischen Wellen, die es gibt. Als masselose und ungeladene Welle hat sie nur eine kleine ionisierende Wirkung, aber eine umso grössere Reichweite. Beim Durchgang durch Materie kann sie je-doch zu angeregten Kernen und damit zu weiteren Zerfallsreaktionen mit entsprechender Strahlung führen.
Neutronen sind im freien Zustand unstabil. Sie entstehen bei der Spaltung grosser Kerne o-der beim Beschuss leichter Kerne.
Die Neutronen-Strahlung wirkt wegen der fehlenden Ladung nicht ionisierend, hat aber ein grosses Durchdringungsvermögen. Leichte Kerne bremsen die Neutronen-Strahlung ab. Langsame Neutronen werden von Kernen eingefangen und bilden so ein neues, oft radioakti-ves Nuklid (Kettenreaktion im Atomreaktor).
Sie besteht aus Atomkernen aus dem Kosmos. Zu 93 % sind dies Protonen. Durch Stösse in der Atmosphäre entstehen viele Generationen energiereicher Teilchen (Sekundärstrahlung).
In solchen Prozessen gebildete Neutronen reagieren mit dem Luftstickstoff zum radioaktiven Isotop 14C. Seine Halbwertzeit ist 5568 Jahre und die Luft enthält einen konstanten Anteil davon (radioaktives Gleichgewicht). Den gleichen Bruchteil enthält ein lebender Organismus. Stirbt er ab, nimmt der Anteil an 14C ab. Daraus kann das Alter von Bäumen, Mumien usw. abgeschätzt werden.
Bezeichnung |
a-Strahlung |
b--Strahlung |
g-Strahlung |
Strahlungsart |
energiereiche |
sehr schnelle |
kurzwellige |
Energieinhalt |
 |
||
Reichweite |
 |
||
Durchdringung |
 |
||
Ionisierung |
 |
||
Strahlenschäden treten dadurch ein, dass Moleküle ionisiert werden und dabei ihre chemischen und physiologischen Eigenschaften verändern.
Sie betreffen nur die Person, die der Strahlung ausgesetzt ist. Sie äussert sich je nach Belastung von Übelkeit und Schwäche bis zu Hautschäden und Strahlenkrebs. Sie führt bei hohen Dosen zum Tod.
Die Wirkung addiert sich hier aber nicht über beliebige Zeiten. Eine geringe Dauerbelastung kann ohne Folgen bleiben, dieselbe Dosis in kurzer Zeit aufgenommen, aber zu einer Erkrankung führen. Für die Grösse somatischer Schäden ist somit vorwiegend die Dosisleistung von Bedeutung.
Unerwünschte Mutationen treten bei der Nachkommenschaft gehäuft auf. Schon ein einziges ionisierendes Teilchen kann in einem Chromosom zu irreversiblen Veränderungen führen. Genetische Schäden addieren sich somit über beliebige Zeiten. Nur die gesamte Dosis über eine bestimmte Zeit ist für die Grösse dieser Schäden ausschlaggebend.
Durch die Verunreinigung von Haut, Kleidung, Nahrung, Luft und Wasser mit radioaktiven Stoffen gelangen diese in den Körper und werden sogar in körpereigene Stoffe eingebaut (radioaktive Iod-, Cäsium-, Calcium-Iostope). Dort Strahlen sie gemäss ihrer Halbwertzeit wei-ter und können nicht oder nur schwer entfernt werden.
Die Messgeräte nützen die Eigenschaften der radioaktiven Strahlung aus:
- ionisierende Wirkung (Geigerzähler, Pendosimeter)
- Fluoreszenzerzeugung (Szintillationszähler)
- photographische Schwärzung (Dosimeter)
Er besteht aus einem gegen das Gehäuse isolierten Draht, an dem eine positive Spannung angelegt ist. Im Rohr befindet sich ein Gas von niederem Druck. Jedes eintretende ionisierende Teilchen macht im Gas Ionen frei, die zum Draht beschleunigt werden. In der Umge-bung des Drahtes lösen sie durch weitere Stösse eine "Ionenlawine" aus, die beim Aufprall auf den Draht einen Stromstoss erzeugt. Dieser wird verstärkt und einem Zähler zugeführt. Zum Nachweis von Gamma-Strahlung und Neutronen-Strahlung wird das Rohr mit einer Substanz ausgelegt, in der eine ionisierende Sekundärstrahlung erzeugt wird.
Während mit dem Geigerzähler Aktivitäten und Dosisleistungen gemessen werden, misst das Pendosimeter die Strahlendosis in einer bestimmten Zeit. Es besteht aus zwei auf verschiedenem Potential gehaltenen Elektroden. Dazwischen befindet sich ein Gas. Die durch die einfallende Strahlung erzeugten Ionenpaare wandern zu den Elektronen und bewirken einen Spannungsabfall. Dieser lässt auf die Strahlendosis schliessen.
Beim Durchgang durch Materie kann radioaktive Strahlung Elektronen der Hülle anregen, was zur Aussendung von Licht führt. Jedes eindringende Teilchen erzeugt im Leuchtstoff einen Lichtblitz, der mit Hilfe einer Fotozelle registriert und einem Zähler zugeführt werden kann.
Mit diesem Gerät wird die Strahlendosis gemessen. Radioaktive Strahlung schwärzt eine photographische Schicht. Je länger und je intensiver sie einwirkt, umso stärker ist die Schwärzung.
Ionendosis I |
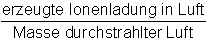 |
[I] = 1 C/kg |
Energiedosis D |
 |
[D] = 1 Gray = 1 J/kg |
Äquivalenzdosis DÄ |
Energiedosis D x Qualitätsfaktor Q |
[DÄ] = 1 mrem = 10 Gray |
Wenn der Umgang mit radioaktiven Stoffen nicht zu vermeiden ist, gelten die folgenden Richtlinien:
- |
Abstand halten |
- |
Zeit verkürzen |
- |
Abschirmung errichten |
- |
Inkorporation vermeiden |
- |
Strahlendosis dauernd messen und kontrollieren lassen |
Durch Beschiessen der Atome mit Elektronen kann man aus der Hülle Elektronen abspalten. Dazu braucht es verschieden grosse Energiemengen (Ionisierungsenergien). Aufgrund dieser Ionisierungsenergien kann man auf eine Elektronenstruktur in der Hülle schliessen:
Die Elektronen bewegen sich um den Kern. Jedem Elektron kann ein Aufenthaltsraum mit einem bestimmten Abstand vom Kern zugeordnet werden. Diesen Aufenthaltsraum nennt man Schale. In einer Schale können sich mehrere Elektronen aufhalten. Ihre Bewegung entspricht jeweils einem ähnlichen Energieinhalt, der umso grösser ist, je weiter die Schale vom Kern entfernt liegt.
Die grössten Atome haben bis 7 solcher Schalen. Sie werden von innen nach aussen mit den Buchstaben K, L, M, N, O, P und Q bezeichnet. Entsprechend ihrer Entfernung vom Kern tragen sie auch eine der Schalennummern 1 bis 7. Die entsprechende Schalennummer wird auch als Hauptquantenzahl n des Elektrons bezeichnet.
Mit steigender Schalennummer kann eine Schale mehr Elektronen aufnehmen. Die maximale Anzahl freier Plätze für Elektronen berechnet sich mit der Formel:
Anzahl e- = 2 · n2
Schale |
Hauptquantenzahl |
max. Elektronenzahl |
K-Schale |
1 |
2 |
L-Schale |
2 |
8 |
M-Schale |
3 |
18 |
N-Schale |
4 |
32 |
O-Schale |
5 |
50 |
P-Schale |
6 |
72 |
Q-Schale |
7 |
98 |
Die Besetzung der Schalen mit Elektronen erfolgt von innen nach aussen, also nach zunehmendem Energieinhalt der Elektronen. Die Schalen werden durch konzentrische Kreise dargestellt.

OZ |
Element |
Anzahl Elektronen |
||
|
|
K-Schale |
L-Schale |
M-Schale |
1 |
H |
1 |
|
|
2 |
He |
2 |
|
|
3 |
Li |
2 |
1 |
|
4 |
Be |
2 |
2 |
|
5 |
B |
2 |
3 |
|
6 |
C |
2 |
4 |
|
7 |
N |
2 |
5 |
|
8 |
O |
2 |
6 |
|
10 |
Ne |
2 |
8 |
|
11 |
Na |
2 |
8 |
1 |
12 |
Mg |
2 |
8 |
2 |
13 |
Al |
2 |
8 |
3 |
14 |
Si |
2 |
8 |
4 |
15 |
P |
2 |
8 |
5 |
16 |
S |
2 |
8 |
6 |
17 |
Cl |
2 |
8 |
7 |
18 |
Ar |
2 |
8 |
8 |
Dieses einfache Schalenmodell ist allerdings nur bis zum Element der Ordnungszahl 18 anwendbar. Bei den folgenden Elementen zeigt sich, dass die M-Schale nicht bis auf 18 aufgefüllt wird, sondern dass vorher die K-Schale mit 8 Elektronen besetzt wird. Diese und andere "Unregelmässigkeiten" lassen sich nur durch eine Erweiterung des Schalenmodells erklären:
Während dem die Hauptquantenzahl oder die Schalennummer der Entfernung des Aufenthaltsraums eines Elektrons vom Kern entspricht, ergibt sich eine weitere Unterteilung der Schalen in Nebenzustände aus den verschiedenen Formen der Ladungswolken, die durch die sich bewegenden Elektronen gebildet werden.
Die Nebenquantenzahl s ist einer kugelförmigen, die Nebenquantenzahl ist p einer hantel-förmigen und die Nebenquantenzahlen d und f sind komplizierteren Gebilden zugeordnet.
Die Elektronen bilden immer paarweise eine solche Ladungswolke, die man auch als Orbital bezeichnet. Innerhalb eines Nebenzustandes unterscheiden sich die Orbitale im weiteren durch ihre Lage im Raum, d.h. durch die Magnetische Quantenzahl. Aus geometrischen Gründen sind für den s-Zustand eine, für den p-Zustand drei, für den d-Zustand fünf und für den f-Zustand sieben räumliche Ausrichtungen möglich. Sie können somit auch nur eine bestimmte Anzahl von Elektronen aufnehmen:
s-Zustand |
1·2e- = 2e- |
p-Zustand |
3·2e- = 6e- |
d-Zustand |
5·2e- = 10e- |
f-Zustand |
7·2e- = 14e- |
Vergleicht man diese Zahlen mit den maximalen Elektronenzahlen der Schalen, so zeigt sich, dass nicht in jeder Schale alle vier Nebenzustände vorkommen können:
K-Schale |
nur s-Zustand |
L-Schale |
nur s- und p-Zustand |
M-Schale |
nur s-, p- und d-Zustand |
ab N-Schale |
alle Nebenzustände |
Die beiden Elektronen eines Orbitals unterscheiden sich nur noch in der Richtung ihrer Eigendrehung, in der sogenannten Spinquantenzahl.
Eine Regel besagt, dass die Orbitale eines Nebenzustands vorerst nur von je einem Elektron besetzt sind und dass sie erst dann, je nach Elektronenzahl, zu Paaren vervollständigt werden.
Um die Elektronenanordnung, die Elektronenkonfiguration, eines Atoms darzustellen, kann das "Kästchenmodell" benutzt werden:
- Die Elektronen sind durch Pfeile dargestellt.
- Ein Kästchen bedeutet ein Orbital.
- Verbundene Kästchen sind ein Nebenzustand
- Die Höhe der Kästchen über der Abszisse entspricht dem Energieinhalt.
Beispiel: Sauerstoff 8O
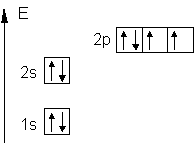 |
Vereinfachte Schreibweise: 1s2 2s2 2p4 |
Nach dem Element Argon, d.h. nach dem Nebenzustand 3p, ist der Auffüllmechanismus nicht mehr regelmässig. Die Energieinhalte der einzelnen Schalen und Nebenzustände überlappen sich. Die Reihenfolge der aufzufüllenden Nebenzustände kann der folgenden Aufstellung (et-was vereinfacht) entnommen werden:
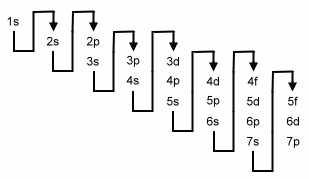
Beispiel: Eisen 26Fe
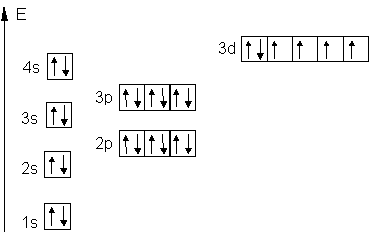 |
1s2 2s2 2p6 3s2 3p6 4s2 3d6
Beispiel: Francium 87Fe
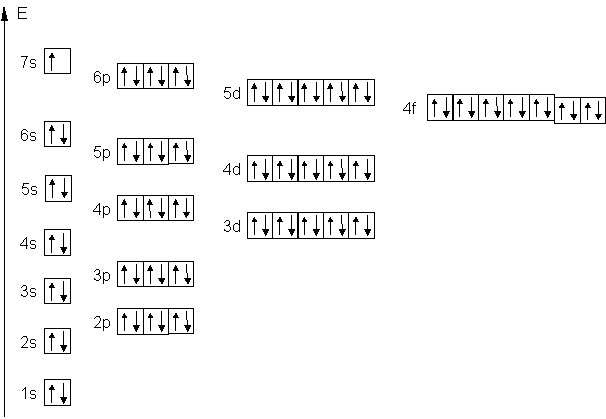 |
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s1
Trotz der auffallenden Verschiedenartigkeit der Elemente lassen sich auch manche Beziehungen und Ähnlichkeiten zwischen ihnen erkennen. Schon sehr früh wurden deshalb Versuche unternommen, die Elemente einzuteilen.
Zu Beginn des 19. Jahrhunderts erkannte man, dass die Atommasse von Strontium ziemlich genau in der Mitte zwischen den Atommassen der beiden dem Strontium physikalisch und chemisch sehr ähnlichen Metallen Calcium und Barium liegt. Man nannte diese drei Metalle eine Triade von Elementen. Weitere solche Triaden bilden z.B. Lithium, Natrium und Kalium oder Chlor, Brom und Iod.
Um 1869 stellten zwei Wissenschaftler unabhängig voneinander fest, dass die Eigenschaften der Elemente in periodischer Weise regelmässig wechseln, wenn man sie nach zunehmender Atommasse anordnet. Auf Metalle folgen Elemente mit weniger ausgeprägt metallischem Charakter, dann Nichtmetalle, nachher wieder typische Metalle und so weiter. Indem man die Elemente mit ähnlichen Eigenschaften untereinanderstellte, ergab sich das Periodensystem der Elemente.
Damit jeweils überall wirklich chemisch ähnliche Elemente untereinander gestellt werden konnten, musste man zunächst an verschiedenen Stellen Lücken für noch nicht entdeckte Elemente offen lassen, deren Eigenschaften sich teilweise mit verblüffender Genauigkeit voraussagen liessen (z.B. Germanium). Später erkannte man aus einigen Unregelmässigkeiten, dass nicht die Atommasse, sondern die Kernladungszahl (Ordnungszahl) die Reihenfolge der Elemente bestimmt, und das Periodensystem konnte in engen Zusammenhang mit dem Bau der Atome gebracht werden.
1. |
Die Anordnung der Elemente erfolgt nach steigender Ordnungszahl. Zur Zeit sind 109 Elemente bekannt. Die Elemente bis Ordnungszahl 93 sind natürlich vorkommende Elemente. Alle anderen sind künstlich durch Kernreaktionen erzeugt worden. |
2. |
Immer wenn sich die Eigenschaften wiederholen, wird eine neue Zeile begonnen. Eine solche Zeile wird Periode genannt. Alle Elemente in derselben Periode haben gleich viele Schalen. |
3. |
Die senkrecht untereinander stehenden Elemente mit ähnlichen Eigenschaften bilden eine Gruppe. Sie weisen jeweils eine ähnliche Konfiguration der Elektronen auf. Die Gruppen werden in 8 Hauptgruppen und 10 Nebengruppen aufgeteilt. In jeder Hauptgruppe stehen Elemente, die der Hauptgruppennummer entsprechend jeweils gleich viele Elektronen in der letzten Schale aufweisen. Diese sind für die chemischen Eigenschaften des Elements verantwortlich und werden auch als Valenzelektronen bezeichnet. Die Gruppen tragen Namen, die vom ersten Element oder von den typischen Gruppeneigenschaften abgeleitet sind: |
Hauptgruppe |
Gruppenname |
Elektronenkonfiguration |
I |
Alkalimetalle |
s1 |
II |
Erdalkalimetalle |
s2 |
III |
Erdmetalle |
s2p1 |
IV |
Kohlenstoffgruppe |
s2p2 |
V |
Stickstoffgruppe |
s2p3 |
VI |
Chalkogene |
s2p4 |
VII |
Halogene |
s2p5 |
VIII |
Edelgase |
s2p6 |
|
Zwischen der zweiten und dritten Hauptgruppe liegen die Nebengruppen. Bei diesen Elementen bleiben die Elektronen der letzten Schale des vorangehenden Elements der zweiten Hauptgruppe erhalten und es erfolgt der Aufbau der zweitletzten Schale von 9 bis 18 Elektronen durch Elektronen im d-Nebenzustand. Die Elemente der Nebengruppen werden auch als d-Elemente bezeichnet.
Zwischen den Nebengruppen IIIa und IVa sind in der 6. Periode die Lanthanide und in der 7. Periode die Actinide eingeschoben. Bei diesen Elementen wird die drittletzte Schale mit Elektronen im f-Nebenzustand von 19 auf 32 Elektronen aufgebaut. Es gibt somit je 14 Actinide und Lanthanide, die oft auch als neunte und zehnte Nebengruppe betrachtet und als f-Elemente bezeichnet werden. |
4. |
In Bezug auf ihre Eigenschaften können die Elemente auch in Metalle, Halbmetalle und Nichtmetalle eingeteilt werden. |
Aus der Stellung eines Elements im PSE kann man bestimmte Eigenschaften ableiten. Für viele physikalische und chemische Eigenschaften lassen sich Tendenzen ablesen:
- |
Metallcharakter und Atomradius nehmen in der Gruppe zu, in der Periode ab. |
- |
Schmelz- und Siedepunkt, Farbtiefe, Dichte und Löslichkeit der Salze nehmen innerhalb einer Gruppe zu. |
Ausführlichere Periodensysteme dienen als Tabellenwerke für viele spezifische Stoffkonstanten. So ist z.B. die durchschnittliche Atommasse der natürlich vorkommenden Isotopengemische der Elemente in der atomaren Masseneinheit 1 u, die relative Atommasse, in fast allen Periodensystemen angegeben.