Die Chemie ist eine der jüngsten Naturwissenschaften. Als selbständige Wissenschaft entstand sie erst im Laufe des 17. Jahrhunderts. Während langer Zeit wurden die Betätigungen, welche sich allmählich von der Alchimie zur heutigen Chemie entwickelten, ziemlich planlos betrieben. Erst sehr spät setzte sich die Erkenntnis durch, dass es die eigentliche Aufgabe der Chemie sei, die Eigenschaften und die wechselseitigen Umwandlungen der verschiedenen Stoffe zu erforschen.
Chemie der Alten (bis cà. 300 n.Chr.)
Im ganzen Altertum war die Chemie im heutigen Sinne unbekannt. Vereinzelte Kenntnisse in chemischer Hinsicht brachte die tägliche Erfahrung; es fehlte jedoch die planmässige weitere Erforschung. Immerhin kannten bereits die Ägypter um 1500 v.Chr. neben der Herstellung keramischer und metallischer Gegenstände auch die Gewinnung von Farbstoffen aus Pflanzen und Tieren, die Essigbereitung, die Glasherstellung und die Zubereitung von Heilmitteln, Salben und Schminken.
Alchimie (bis cà. 1500)
Im Verlaufe des Überganges vom Altertum zum Mittelalter übernahmen die Araber die ägyptischen Erkenntnisse, entwickelten sie weiter und vermittelten sie später an die europäischen Völker. Diese verwendeten den Ausdruck "Alchimie" für die Kunst, Elemente ineinander umzuwandeln, wobei allerdings noch ausschliesslich die sog. Elementenlehre herrschend war. Danach waren alle Stoffe aus den vier Elementen Luft, Wasser, Erde und Feuer aufgebaut. Diese "Elemente" bedeuteten aber weniger etwas Stoffliches, sondern hatten eher den Sinn von Eigenschaften. Für weitere Elemente hielten die Alchimisten später Quecksilber, welches das Metallische verkörperte, und Schwefel, das Brennbare. Mit allen Mitteln suchte man nach dem geheimnisvollen "Stein des Weisen" oder der "essentia quinta", mittels welchem es möglich sein sollte, billige Stoffe in Gold zu verwandeln.
Die Entwicklung der Alchimie wurde durch allerlei philosophische und religiöse Ideen beeinflusst, und die mit ihren magischen Gedanken oft schwer verständliche alchimistische Literatur sowie das geheimnisvolle, oft auch betrügerische Gebaren ihrer Jünger, trugen dazu bei, die Alchimie als "schwarze Kunst" in Verruf zu bringen.
Iatrochemie (ab cà. 1500)
Erste Ansätze, die aus den Verkrustungen der Alchimie herausführen, bilden die vom Arzt Paracelsus vertretenen Ideen. Er erkannte die Abhängigkeit des Lebens von den stofflichen Grundlagen und dass die Lebensvorgänge durch diese beeinflussbar sind. Er war der Begründer der pharmazeutischen Chemie.
Phlogistische Chemie (bis cà. 1800)
Langsam begann sich die Chemie als besonderer Zweig aus der Wissenschaft von der Natur herauszubilden. Der diese Anfänge bestimmende Phlogismus nahm an, dass alle brennbaren Stoffe einen Feuerstoff (Phlogiston) enthielten, der beim Verbrennen entweicht. Diese Annahme verrät die immer noch nachwirkende Verquickung mit dem Geheimnisvollen und Magischen.
Neuzeitliche Chemie (ab cà. 1500)
Die neuzeitliche Chemie begann, als man ganz bewusst anstelle mystischer Spekulationen das Experiment in den Mittelpunkt stellte. Zu Beginn beschäftigte man sich vorallem mit der Erscheinung der Verbrennung. Durch ihre richtige Deutung und die Untersuchung der Luft stiess man auf die Gase Stickstoff und Sauerstoff und erkannte sie als Elemente.
Viele bedeutende Wissenschafter arbeiteten an den geschaffenen Grundlagen weiter und verschafften der neuen Wissenschaft Anerkennung und Aufnahme an den Universitäten.Um die Mitte des 19. Jahrhunderts begann die Chemie zu einem wirtschaftlichen Faktor zu werden, als die Synthese der ersten organischen Verbindung gelang. Es wurden neue Elemente entdeckt und das Periodensystem entwickelt.
Seit Beginn des 20. Jahrhunderts entstand die eigentliche Grosschemie. Die Aufstellung des Elektronenschalen-Atommodells, die Entdeckung der Kernumwandlung und die Synthese von Kunststoffen sind weitere Stationen auf dem Weg zur heutigen Chemie.
Heute ist die Chemie kaum mehr aus unserem Leben wegzudenken. Jeder von uns geht im Alltag ständig mit Dingen der Chemie um. Zivilisation, Technik und Chemie haben aber auch Gefahren mit sich gebracht. Durch die Gewässer-, Boden- und Luftverschmutzung ist unsere natürliche Umwelt bedroht. Der unsachgemässe und missbräuchliche Umgang mit Schädlingsbekämpfungsmitteln, Arzneimitteln und Drogen gefährdet unsere Gesundheit. Die Rohstoffe werden knapp. In diesen Problemen liegt die grosse Herausforderung an die heutige moderne Chemie und Technik.
primitive Geräte, zufällige Versuche
geheime Zeichensprache
Zauberei und philosophische Spekulationen
keine wirtschaftliche Bedeutung
alte Elementenlehre
Die Chemie ist eine Naturwissenschaft. Sie befasst sich mit Stoffen, ihren Eigenschaften und wechselseitigen Umwandlungen.
Physikalische Vorgänge sind nicht mit stofflichen Veränderungen verbunden und wiederholbar.
Mahlen von Korn |
Rosten von Eisen |
|
Lösen von Salzen |
Verbrennen von Holz |
|
Schmelzen von Eis |
Gären von Most |
|
Herunterfallen von Dingen |
Verdauung |
Aufbau und Eigenschaften der Stoffe. Gesetze, nach denen sie sich verändern und umwandeln. Verhalten unter verschiedenen Bedingungen.
Zerlegung der Stoffe zur Ermittlung ihrer Zusammensetzung und chemischen Struktur
Nachweis von Stoffen oder Bestandteilen
mengenmässige Zusammensetzung
Herstellung und Umwandlung von Stoffen
Chemie der Substanzen ohne Kohlenstoff
Chemie der Kohlenstoffverbindungen
Chemie der Lebensvorgänge
Als Stoff bezeichnen wir alle Dinge, die durch unsere Sinne wahrnehmbar sind, eine Masse haben und Raum einnehmen.
Um einen Stoff zu kennzeichnen und zu charakterisieren untersucht man seine arteigenen,spezifischen Eigenschaften.
| Form | Aggregatzustand | ||
| Farbe | Zähigkeit | ||
| * | Dichte | * | Brechungsindex |
| * | Schmelzpunkt | * | Oberflächenspannung |
| * | Siedepunkt | Härte |
Merke:
Zur Kennzeichnung am besten geeignet sind messbare Eigenschaften (*), sogenannte Grössen.
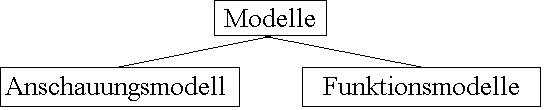
Der Aufbau der Stoffe und die Vorgänge bei chemischen Umsetzungen sind nicht von Auge beobachtbar. Zu deren Beschreibung müssen Modellvorstellungen herangezogen werden.

Die Modelle der Chemie sind immer Funktionsmodelle.
Sie stellen kein Abbild der Wirklichkeit dar. Sie können nie die absolute Wahrheit treffen und müssen ständig den neuesten Erkenntnissen und Bedürfnissen angepasst werden.
Wird ein Stoff zerkleinert, entstehen viele kleinere Teilchen, die alle noch die typischen Eigenschaften des Stoffes tragen. Führt man diesen Vorgang immer weiter, gelangt man an eine Grenze, wo die Teilchen nicht mehr geteilt werden können, ohne dass sie die spezifischen Eigenschaften des Stoffes verlieren. Man ist bei den Kleinsten Teilchen des Stoffes angelangt.
1. |
Jeder Stoff ist aus kleinsten Teilchen aufgebaut, die Träger der Stoffeigenschaften sind. |
2. |
Zwischen den Teilchen wirken Anziehungskräfte. |
3. |
Die Teilchen sind in Bewegung und streben auseinander. |
4. |
Die Teilchen können Atome, Moleküle oder Ionen sein. |
Das Modell der Kleinsten Teilchen ist geeignet, auf einfache Art und Weise das verschiedene physikalische Verhalten der Stoffe in Abhängigkeit der Temperatur zu erklären.
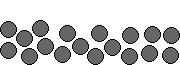
Je nach Aggregatzustand sieht der Aufbau des Stoffes aus diesen Kleinsten Teilchen anders aus:
Aggregatzustand |
fest |
flüssig |
gasig |
Modell |
 |
 |
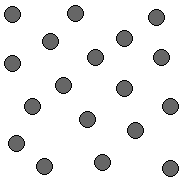 |
Anziehungskräfte |
stark |
schwach |
keine |
Bewegung |
ortsgebundene Schwingungen |
beweglich im Verband |
frei im ganzen Raum |
Form |
bestimmt |
variabel |
keine |

Erwärmen
Teilchenbewegung wird schneller, Teilchen brauchen mehr Platz (Ausdehnung)
Schmelzen
Ordnung fällt, Teilchen erhalten grössere Bewegungsfreiheit, zum Aufbrechen der Ordnung braucht es die Schmelzwärme. Beim Erstarren wird sie wieder freigesetzt.
Lösen
Lösemittel-Teilchen reissen durch ihre Bewegung die Teilchen aus dem Verband. Die dazu benötigte Lösewärme wird beim Auskristallisieren wieder freigesetzt.
Verdampfen
Teilchen erlangen höchste Bewegungsfreiheit, letzte Anziehung wird überwunden, dazu braucht es Verdampfungswärme, die beim Kondensieren wieder freigesetzt wird.
Verdunsten
Einzelne Teilchen haben genug Energie, um Verband zu verlassen (Abkühlung).
Sublimieren
Teilchen entweichen aus dem Kristall, ohne dass dieser zerstört wird (Sublimationswärme = Schmelzwärme + Verdampfungs- wärme).
amorph
Feste Körper, die keine regelmässige Ordnung im Aufbau (Kristallgitter) haben, nur ihre Zähigkeit ändert mit der Temperatur.
Plasma
Entsteht über 1000°C, Atome ionisiert, elektrisch leitfähig (Lichtbogen, heisse Flamme, Fixsterne).
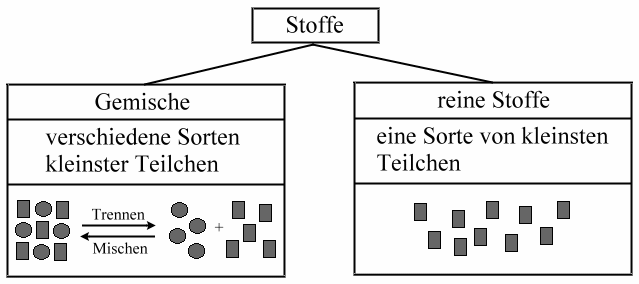
Das Verhältnis der Mischungsanteile ist beliebig.
Die Eigenschaften der Komponenten bleiben erhalten.
Sie sind durch physikalische Methoden trennbar.
Gemische können weiter unterteilt werden in:
Komponenten sind auch mit Mikroskop nicht unterscheidbar. Trennbar durch Destillieren, Kristallisieren, Extrahieren, Chromatografieren.
Stoff ist mikroskopisch fein im Medium verteilt.
Komponenten sind mit Auge oder Lupe unterscheidbar, unterscheidbare Komponenten sind Phasen des Gemisches. Trennbar durch Sedimentieren, Filtrieren, Zentrifugieren
Je nach Aggregatzustand der Bestandteile haben bestimmte Gemische spezielle Bezeichnungen:
heterogenes Gemisch von Feststoffen
Granit, Nagelfluh, Kuchen
homogenes Gemisch von Feststoffen und Flüssigkeiten
Zuckerwasser, Salzlösung, verd. Alkohol
homogenes Gemisch mit Metallen
Messing, Stahl
heterogenes Gemisch fest in flüssig
Sand/Wasser
heterogenes Gemisch flüssig in flüssig
Milch, Mayonnaise
heterogenes Gemisch gasig in flüssig oder fest
Badeschaum, Schaumstoff
heterogenes Gemisch flüssig in gasig
Wolken, Dampf
heterogenes Gemisch fest in gasig
Feuerrauch
kolloidales Gemisch von fest oder flüssig in gasig
Sprühnebel, feinste Stäube
kolloidales Gemisch von fest oder flüssig in flüssig
trübes Wasser, Dispersionsfarbe
In der Natur liegen die Stoffe fast ausschliesslich als Gemische vor. Die Chemie verwendet aber nur (nahezu) reine Stoffe. Eine wichtige Aufgabe von Technik und Wissenschaft ist deshalb die Isolierung von reinen Stoffen aus natürlichen Gemischen.
Physikalische Trennungsmethoden verändern die Eigenschaften der beteiligten Stoffe nicht. Zur Stofftrennung werden lediglich die verschiedenen physikalischen Eigenschaften der Gemischkomponenten ausgenutzt:
A |
Dichte |
B |
Benetzbarkeit |
C |
Partikelgrösse |
D |
Löslichkeit |
E |
elektrische Aufladbarkeit |
F |
Adsorbierbarkeit |
G |
elektrische Ladung |
H |
Siedepunkt/Dampfdruck |
Trennverfahren |
Eigenschaft |
Beispiele |
Sedimentieren |
A |
|
Sieben |
C |
|
Extrahieren |
D |
|
Destillieren |
H |
|
Sublimieren |
H |
|
Flotieren |
B |
|
Zentrifugieren |
A |
|
Lyophilisieren |
H |
|
Filtrieren |
C |
|
Eindampfen |
D/H |
|
Kristallisieren |
D |
|
Elektrofiltrieren |
E |
|
Abscheiden |
A |
|
Chromatografieren |
D/F |
|
Elektrophorese |
G |
|
Entgasen |
D |
|
Auswaschen |
D |
|
Kondensieren |
H |
|
Adsorbieren |
F |
Durch die physikalische Auftrennung von Gemischen gelangt man zu den Reinen Stoffen.
Reine Stoffe besitzen spezifische physikalische und chemische Eigenschaften.
Reine Stoffe lassen sich durch physikalische Methoden nicht mehr zerlegen.

Die Verbindungen haben andere Eigenschaften als die daran beteiligten Elemente.
Verbindungen lassen sich nur durch chemische Vorgänge wieder in die Elemente zerlegen.
Die kleinsten Teilchen der Verbindungen sind Moleküle oder Ionen.
Beispiele
Schwefelsäure, Ammoniak, dest. Wasser, Ether
Bei einer chemischen Trennungsmethode entstehen neue Stoffe, die durch blosses Mischen nicht wieder den Ausgangsstoff ergeben.
chemische Aufspaltung von Verbindungen
chemische Aufspaltung durch Wärme
chemische Aufspaltung durch elektrischen Strom
chemischer Aufbau von Verbindungen
Aus der analytischen Untersuchung von Verbindungen ergibt sich, dass sich bei chemischen Reaktionen die einzelnen Elemente nur in festen Massenverhältnissen miteinander verbinden. J.Proust formulierte aus dieser Tatsache das Gesetz von den konstanten Proportionen:
Das Massenverhältnis zweier sich zu einer chemischen Verbin- dung vereinigender Elemente ist konstant.
Beispiel:
Zerlegt man die Verbindung Wasser, so entstehen daraus die beiden Gase Wasserstoff und Sauerstoff stets im konstanten Volumenverhältnis 2 : 1. Umgekehrt entstehen aus 1 Massenteil Wasserstoff und 8 Massenteilen Sauerstoff in der Knallgasreaktion 9 Massenteile Wasser. Ist das Volumenmischungsverhältnis der Ausgangsgase nicht 2 : 1, so nimmt der überschüssige Anteil an der Reaktion nicht teil.
Entstehen bei der Wechselwirkung zweier Elemente mehrere Verbindungen, so gilt das umfassendere Gesetz der multiplen und konstanten Proportionen:
Die Massenverhältnisse zweier sich zu verschiedenen chemischen Verbindungen vereinigender Elemente stehen zueinander im Verhältnis einfacher ganzer Zahlen.
Beispiel:
Stickstoff und Sauerstoff können zu fünf verschiedenen Verbindungen zusammentreten:
Verbindung |
Massenverhältnis N : O |
Stickstoff(I)-oxid |
1 : 0,571 = 1 : (1·0,571) |
Stickstoff(II)-oxid |
1 : 1,142 = 1 : (2·0,571) |
Stickstoff(III)-oxid |
1 : 1,713 = 1 : (3·0,571) |
Stickstoff(IV)-oxid |
1 : 2,284 = 1 : (4·0,571) |
Stickstoff(V)-oxid |
1 : 2,855 = 1 : (5·0,571) |
Aus dem Gesetz der konstanten Proportionen folgt, dass sich die Elemente in einer bestimmten Verbindung immer im gleichen Atomzahlenverhältnis zusammenschliessen. In der Summenformel geben die tiefgestellten Zahlen hinter dem Elementsymbol (Index) dieses Atomzahlenverhältnis wider.
Beispiel:
In der Verbindung Stickstoff(III)-oxid sind die Elemente Stickstoff und Sauerstoff im Massenverhältnis 1 : 1,713 verbunden. Die Atommassen der Elemente verhalten sich wie 14 : 16. Dies ergibt ein Atomzahlenverhältnis von 0,07143 : 0,1072 oder in kleinsten ganzen Zahlen von 2 : 3. Die Summenformel lautet demnach N2O3.
Aus den verschiedenen Atomzahlenverhältnissen in Verbindungen geht hervor, dass die Elemente eine verschieden grosse Bindungsfähigkeit haben. So verbindet sich z.B. Chlor mit Wasserstoff im Atomzahlenverhältnis 1:1, mit Schwefel dagegen im Verhältnis 2:1. Also haben Chlor und Wasserstoff die gleiche Bindungsfähigkeit, der Schwefel aber eine doppelt so grosse.
Die Elementenwertigkeit (stöchiometrische Wertigkeit) ist ein zahlenmässiger Ausdruck dafür, in welchem Atomzahlenverhältnis sich Elemente miteinander verbinden oder verbunden haben.
Das Element mit der kleinsten Bindungsfähigkeit ist der Wasserstoff. Er tritt in Verbindungen immer mit der grössten Atomzahl auf. Ihm wird deshalb die Wertigkeit I (römische Ziffern) zugeordnet. Alle anderen Wertigkeiten von Elementen werden von ihm abgeleitet.
Die Wertigkeit eines Elements entspricht der Anzahl Wasserstoff- atome, mit denen sich ein Atom dieses Elements verbunden hat oder wieviele Wasserstoffatome es in einer Verbindung ersetzt hat.
Beispiele:
Verbindung |
Wertigkeit von |
Verbindung |
Wertigkeit von |
||
NH3 |
N |
III |
CO2 |
C |
IV |
H2O |
O |
II |
Cl2O |
Cl |
I |
MgO |
O |
II |
HBr |
Br |
I |
CH4 |
C |
IV |
H2S |
S |
II |
Für die Wertigkeiten der Elemente lassen sich folgende Regeln feststellen (nach abnehmender Priorität geordnet):
1. |
Wasserstoff und Fluor haben immer die Wertigkeit I. |
2. |
Die Alaklimetalle (Li,Na, K) haben immer die Wertigkeit I, die Erdalkalimetalle (Mg, Ca) die Wertigkeit II und Aluminium (Al) die Wertigkeit III |
3. |
Sauerstoff hat immer die Wertigkeit II |
4. |
Halogene haben in Salzen immer die Wertigkeit I |
Formel |
Wertigkeiten |
Formel |
Wertigkeiten |
P2O3 |
III ; II |
Cl2O7 |
VII ; II |
FeCl3 |
III ; I |
MgCl2 |
II ; I |
MgO2 |
II ; I |
PF3 |
III ; I |
KBr |
I ; I |
Al2O3 |
III ; II |
SO3 |
VI ; II |
MnO2 |
IV ; II |
Aus den Wertigkeiten kann umgekehrt auch die Summenformel einer Verbindung abgeleitet werden:
Bindungspartner |
Formel |
Bindungspartner |
Formel |
Schwefel(IV) |
SO2 |
Eisen(III) |
Fe2S3 |
Phosphor(V) |
P2O5 |
Kupfer(II) |
CuBr2 |
Aluminium |
AlCl3 |
Kohlenstoff(II) |
CO |
Elemente sind auch chemisch nicht weiter auftrennbar.
Die kleinsten Teilchen sind Atome oder Moleküle, die nur aus einer Atomsorte bestehen.
In der Natur kommen, meist in Form von Verbindungen, 92 Elemente vor. Sie tragen Symbole, die oft von lateinischen Namen abgeleitet sind.
Beispiele:
Sauerstoff |
O |
Wasserstoff |
H |
Stickstoff |
N |
Kohlenstoff |
C |
Natrium |
Na |
Eisen |
Fe |
Kupfer |
Cu |
Silber |
Ag |