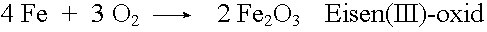
Die Oxidation ist in der ursprünglichen Erklärung die Vereinigung eines Elementes mit Sauerstoff. Dabei entstehen Verbindungen, deren Namen sich vom Sauerstoff ableiten: Oxide.
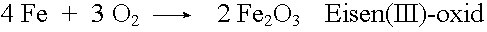
Verbrennungen sind nichts anderes als sehr rasch ablaufende, stark exotherme Oxidationen. Unvollständig verbrannter Brennstoff verursacht durch sein Aufglühen in der Hitze das Leuchten der Flamme.
Es gibt aber auch langsame oder stille Oxidationen, wie das Rosten von Metallen oder die Oxidation der mit der Nahrung aufgenommenen Kohlenhydrate im Körper.
Stufenweise Oxidationen sind bei den Elementen anzutreffen, die in mehreren Wertigkeitsstufen auftreten können.
| Eisen: | 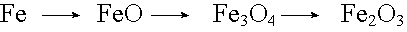 |
| Blei: |  |
Die Oxidation kann auch als Wasserstoffentzug aufgefasst werden.
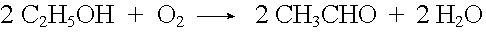
Stoffe, die Sauerstoff abgeben oder Wasserstoff aufnehmen können sind Oxidationsmittel:
O2, O3, HNO3, H2O2, KClO3, KClO4, KMnO4, H2SO4
Die Reduktion ist das Gegenteil der Oxidation, nämlich Sauerstoffentzug.
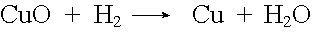
Reduktionen sind endotherme Vorgänge. Sie verbrauchen Wärme und laufen daher bevorzugt bei hohen Temperaturen ab.
Wichtig ist auch die Reduktion als Anlagerung von Wasserstoff.
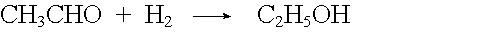
Reduktionsmittel können Sauerstoff aufnehmen oder Wasserstoff abgeben. Wichtige Reduktionsmittel sind:
H2, C, NaHSO3, LiAlH4
Die Oxidation ist mit der Reduktion des Oxidationsmittels, die Reduktion mit der Oxidation des Reduktionsmittels verbunden. Da hiernach Oxidation und Reduktion immer gleichzeitig und nebeneinander ablaufen, spricht man von Redoxreaktionen.

Bei der Oxidation von Eisen in reinem Sauerstoff entsteht die Ionenverbindung Eisenoxid. Jedes Eisenatom gibt drei Elektronen ab und wird zu einem Fe3+-Ion. Die abgegebenen Elektronen werden von den Sauerstoffatomen übernommen, die dadurch zu O2--Ionen werden. Die Oxidation ist somit vom Atombau her gesehen eine Elektronenabgabe. Die Reduktion ist gleichzusetzen mit einer Elektronenaufnahme. Bei einer Redoxreaktion werden Elektronen verschoben.
Oxidation: |
Fe |
 |
Fe3+ + 3 e- |
/ ·4 |
Reduktion: |
O2 + 4 e- |
 |
2 O2- |
/ ·3 |
Redox: |
4 Fe + 3 O2 |
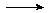 |
2 Fe2O3 |
|
Oxidation |
Abgabe von Elektronen |
Reduktion |
Aufnahme von Elektronen |
Oxidationsmittel |
Elektronenakzeptor |
Reduktionsmittel |
Elektronendonator |
Redoxreaktion |
Reaktion mit Elektronenübergang |
Obige Betrachtungsweise erweitert den Begriff der Redoxreaktionen auch auf Reaktionen, bei denen kein Sauerstoff beteiligt ist.
Oxidation: |
Mg |
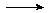 |
Mg2+ + 2 e- |
/ ·1 |
Reduktion: |
Cl2 + 2 e- |
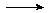 |
2 Cl- |
/ ·1 |
Redox: |
Mg + Cl2 |
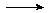 |
MgCl2 |
|
Die Definitionen lassen sich sinngemäss auch auf Molekülverbindungen anwenden.
Die Bindungselektronen werden hier zwar nicht ganz übertragen, doch lassen sie sich in polaren Atombindungen dem elektronegativeren Atom zuordnen.
Oxidation: |
P |
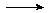 |
P3+ + 3 e- |
/ ·2 |
Reduktion: |
Cl2 + 2 e- |
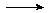 |
2 Cl- |
/ ·3 |
Redox: |
2 P + 3 Cl2 |
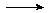 |
2 PCl3 |
|
Der Oxidationsgrad eines Elementes in einer Verbindung ist gegeben durch die Anzahl der bei der Bildung der Bindungen aufgenommenen oder abgegebenen Elektronen. Er wird ausgedrückt durch die sog. Oxidationszahl.
Die Oxidationszahl eines Elementes in einer Verbindung entspricht der formalen Ladung, die ein entsprechendes Atom erhält, wenn die Bindungselektronen aller Bindungen den jeweils elektronegativeren Bindungspartnern zugeordnet werden.
Die Summe der Oxidationszahlen aller Atome in einer Verbindung ist Null, Bei Ionen entspricht sie der tatsächlichen Ladung der Ionen.
Oxidationszahlen werden über dem Elementsymbol als römische Ziffer mit Vorzeichen geschrieben.
+III -II |
+II -I |
+III -I |
+I +VI -II |
+V -II |
Fe2O3 |
MgCl2 |
PCl3 |
H2SO4 |
PO43- |
Für die Ermittlung von Oxidationszahlen gelten aufgrund der Wertigkeiten und Elektronegativitäten der Elemente folgende Regeln (nach Priorität geordnet):
1. |
Jedes ungebundene Atom hat Oxidationszahl 0, ebenso Atome in Molekülen aus gleichartigen Atomen. |
2. |
Fluor hat Oxidationszahl -I. |
3. |
Metalle haben immer positive Oxidationszahlen. Für Hauptgruppenelemente stimmt sie mit der Hauptgruppennummer überein. |
4. |
Wasserstoff hat immer Oxidationszahl +I. |
5. |
Sauerstoff hat immer Oxidationszahl -II. |
6. |
Die kleinst mögliche Oxidationszahl von Nichtmetallen entspricht der Hauptgruppennummer minus acht, sie nehmen diese in Salzen ein.Die grösstmögliche Oxidationszahl entspricht der Hauptgruppennummer. |
|
-III +I |
|
+IV -II |
|
+III -I |
a) |
NH3 |
b) |
CO2 |
c) |
FeCl3 |
|
0 |
|
+I +V -II |
|
+I +VII -II |
d) |
F2 |
e) |
HNO3 |
f) |
KMnO4 |
|
+I -I |
|
+VI -II |
|
+V -II -I |
g) |
H2O2 |
h) |
SO42- |
i) |
POCl3 |
|
+VII -II |
|
+VI -II |
|
+I +III -I |
k) |
ClO4- |
l) |
SO3 |
m) |
LiAlH4 |
Oxidationszahlen sind ein gutes Hilfsmittel zur Beurteilung und Formulierung von Redoxreaktionen.
Oxidation: |
Erhöhung der Oxidationszahl |
Reduktion: |
Herabsetzung der Oxidationszahl |
Bezeichnen Sie in den folgenden Redoxreaktionen mit Hilfe der Oxidationszahlen welches der Elemente oxidiert beziehungsweise reduziert wird:
a) 3 Cu + 8 HNO3
3 Cu(NO3)2 + 2 NO + 4 H2O
b) PbO2 + 4 HI
PbI2 + I2 + 2 H2O
c) PbS + 4 H2O2
PbSO4 + 4 H2O
d) 2 Li + 2 H2O
2 LiOH + H2
Elektronenabgabe und Elektronenaufnahme sind umkehrbare Vorgänge; Redoxvorgänge somit Gleichgewichtsreaktionen.
Ein Reduktionsmittel wird durch die Elektronenabgabe zu einem Oxidationsmittel, weil es in der Rückreaktion die Elektronen wieder aufnimmt. Umgekehrt wird ein Oxidationsmittel durch Elektronenaufnahme zu einem Reduktionsmittel.

Auf diese Weise ist jedem Reduktionsmittel ein ganz bestimmtes, ihm zugehöriges Oxidationsmittel zugeordnet und umgekehrt. Sie bilden zusammen ein korrespondierendes Redoxpaar.
Gleichung |
Kurzschreibweise |
|||
Na |
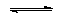 |
Na+ + e- |
Na/Na+ |
|
Fe2+ |
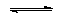 |
Fe3+ + e- |
Fe2+/Fe3+ |
|
2 Cl- |
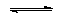 |
Cl2 + 2 e- |
2Cl-/Cl2 |
|
2 H2O + NO |
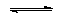 |
NO3- + 4 H+ + 3 e- |
NO/NO3- |
|
4 H2O + Mn2+ |
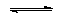 |
MnO4- + 8 H+ + 5 e- |
Mn2+/MnO4- |
An jeder Redoxreaktion sind zwei Redoxpaare beteiligt, zwischen denen der Elektronenaus-tausch stattfindet. Das stärkere Oxidationsmittel (das System mit dem grösseren Bestreben, Elektronen aufzunehmen) wird die Elektronen an sich ziehen und das Gleichgewicht auf seine Seite verschieben.

Beispiel: |
In schwefelsaurer Lösung werden Nitritionen durch Kaliumpermanganat zu Nitrationen oxidiert. Aus dem Kaliumpermanganat enstehen Mn2+-Ionen: |
1. |
Aufstellen der Ionengleichung aus den gegeben Redoxpaaren ohne Koeffizienten und Bestimmung der massgeblichen Oxidationszahlen. |
+III+VII+V+II |
|
NO2- + MnO4- |
2. |
Ermitteln der Elektronenübergänge und Angleichung durch Vervielfachen der Redoxpaare bis die Zahl der aufgenommenen Elektronen gleich der Zahl der abgegebenen ist (kgV). |
5 NO2- + 2 MnO4- |
3. |
Ladungsausgleich durch Ergänzen mit H+ (in alkalischer Lösung mit OH-). |
5 NO2- + 2 MnO4- + 6 H+ |
4. |
Massenausgleich durch Hinzufügen von Wasser. |
5 NO2- + 2 MnO4- + 6 H+ |
5. |
Eventuell Ergänzung der Ionengleichung zur Stoffgleichung mit den entsprechenden Gegenionen. |
5KNO2 + 2KMnO4 + 3H2SO4 5KNO3 + 2MnSO4 + K2SO4 + 3H2O |
Ein Eisennagel wird beim Eintauchen in eine wässrige Lösung von Kupfersulfat verkupfert. Blankes Kupferblech hingegen verändert sich in einer Lösung von Eisensulfat nicht. Bringt man es aber in eine Lösung von Quecksilberchlorid, so scheidet sich metallisches Quecksilber aus. Aufgrund solcher Versuche können die Metalle entsprechend ihrem Vermögen, Ionen anderer Metalle zu reduzieren in einer Reihe, der Spannungsreihe der Metalle angeordnet werden.

Der Wasserstoff ist auch in der Reihe, da er wie die Metalle auch positive Ionen bildet (H+). Alle vor dem Wasserstoff stehenden Metalle reduzieren H+-Ionen zu Wasserstoff, d.h. setzen aus Säuren Wasserstoff frei. Diese Metalle bezeichnet man als unedle Metalle, diejenigen rechts vom Wasserstoff als edle Metalle.
Es ist zweckmässig, nicht nur die Metalle selbst, sondern die ganzen entsprechenden Redoxpaare in einer Reihe, der sog. Redoxreihe anzuordnen. Diese Redoxreihe kann durch andere Redoxpaare, etwa diejenigen der Nichtmetalle, ergänzt werden.
Beispiele aus der erweiterten Redoxreihe:
zunehmend starke Reduktionsmittel |
 |
2F- / F2 |
 |
zunehmend starke Oxidationsmittel |
Zink vermag Kupferionen zu metallischem Kupfer zu reduzieren. Es selbst wird zu Zinkionen oxidiert. Lässt man diese Redoxreaktion in einer Anordnung mit getrennter Oxidation und Reduktion ablaufen und erfolgt die Elektronenübertragung über einen Leiterdraht, spricht man von einer galvanischen Zelle.
Solche Anordnungen (auch galvanische Elemente, galvanische Ketten oder elektrochemische Elemente genannt) geben die Energie exotherm ablaufender chemischer Reaktionen als e-lektrische Energie ab.
Jedes der beiden räumlich getrennten Redoxpaare nennt man eine Halbzelle. Zwischen zwei verschiedenen Halbzellen besteht eine elektrische Spannung.
Jedes Metall besitzt gemäss seinem Reduktionsvermögen das Bestreben, in wässriger Lösung Ionen zu bilden (Lösungsdruck). Dabei bleiben die Elektronen im Metall zurück, welches sich dadurch negativ auflädt.
Andererseits hat jede Ionenlösung das Bestreben, sich zu verdünnen (osmotischer Druck), sodass auch Metall-Ionen in das Metall zurückgeführt und die zurückgebliebenen Elektronen wieder aufgenommen werden.
Es bildet sich ein für jedes Metall charakteristisches, dynamisches Gleichgewicht und ein entsprechendes elektrisches Potential (Elektronendruck).
 Mez+ + z e-
Mez+ + z e-
Zwischen zwei verschiedenen Metallen oder Elektroden besteht somit in einer wässrigen Lösung ein Potentialunterschied und damit eine elektrische Spannung. Das unedlere Metall hat das grössere Potential und bildet den stärker negativ geladenen Teil, also den Minuspol. Verbindet man die beiden Halbzellen, so entsteht ein Elektronenfluss vom Minus- zum Plus-pol, das heisst vom unedleren zum edleren Metall.
Um diesen Elektronenfluss aufrecht zu erhalten, werden nun am Minuspol laufend Metallatome zu Metallionen oxidiert und mit den freiwerdenden Elektronen am Pluspol Metallionen zum Metall reduziert. Die Elektrode, an der die Oxidation abläuft (Minuspol) wird als Anode bezeichnet, die Elektrode, an der die Reduktion abläuft (Pluspol) als Kathode.
Die Vorgänge bewirken in der negativen Halbzelle ein ständiges Anwachsen der Konzentration an positiven Metallionen. In der positiven Halbzelle hingegen nimmt die Konzentration an Metallionen ab. Durch diese Ladungsverschiebung in den Lösungen kommt der Vorgang nach kurzer Zeit zum Stillstand. Will man dies vermeiden, taucht man die Elektroden in ihre Salzlösungen mit negativen Gegenionen und trennt die Halbzellen durch eine poröse Trennwand. Zum Ladungsausgleich wandern nun negative Ionen in den Anodenraum und positive in den Kathodenraum. Der Vorgang kommt somit erst zum Stillstand, wenn die Lösungen durchmischt sind.
Verwendung:Batterien, Akkumulatoren, Korrosion
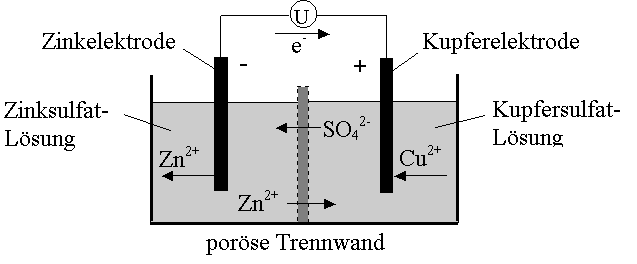
Anode: |
Zn |
 |
Zn2+ + 2 e- |
/ ·1 |
Kathode: |
Cu2+ + 2 e- |
 |
Cu |
/ ·1 |
Gesamtreaktion: |
Zn + Cu2+ |
 |
Zn2+ + Cu |
|
Galvanische Elemente bestehen aus zwei Halbzellen, die je ein Redoxpaar darstellen. Jedes dieser Redoxpaare besitzt ein ganz bestimmtes elektrisches Potential, woraus sich die Potentialdifferenz der Zelle ergibt. Die Potentialdifferenz ist umso grösser, je mehr sich die beiden Oxidationsmittel resp. Reduktionsmittel in ihrer Stärke unterscheiden. Das Potential eines Redoxpaares kann somit als Mass für die Stärke von Oxidations- und Reduktionsmittel benutzt werden. Jeder Halbzelle, d.h. jedem Redoxpaar, wird ein charakteristisches Potential, das Redoxpotential e zugeordnet.
Potentialwerte einzelner Halbzellen können nicht gemessen werden, man kann nur Potentialdifferenzen messen. Man ordnet deshalb willkürlich der Bezugshalbzelle H2/H3O+ bei allen Temperaturen den Wert Null zu.
Die Spannungen, die andere Halbzellen unter Standardbedingungen (1 molare Lösungen, 25°C) gegen die Bezugshalbzelle zeigen, werden als Standardpotentiale e° bezeichnet.
Bildet eine Halbzelle gegenüber der Bezugselektrode den negativen Pol, so wird dem Redoxpaar ein negatives Standardpotential zugeordnet, im andern Fall ein positives.
Die Bezugshalbzelle besteht aus einem Platin-Leiter, der von Wasserstoffgas unter einem Druck von 1,013 bar umspült wird und in eine 1 molare Hydroxoniumionenlösung eintaucht.
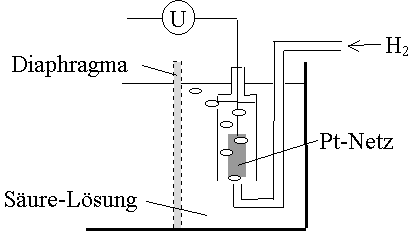
Ordnet man die Halbzellen, resp. korrespondierenden Redoxpaare, nach steigenden Standardpotentialen (unter Berücksichtigung der Polung), in einer Reihe an, so erhält man die elektrochemische Spannungsreihe, welche mit der Redoxreihe identisch ist.
In der Tabelle gelten folgende Beziehungen:
Metalle und Nichtmetallionen sind umso stärkere Reduktionsmittel, je negativer ihr Standardpotential ist.
Metallionen und Nichtmetalle sind umso stärkere Oxidationsmittel, je positiver ihr Standardpotential ist.
Standardpotentiale dienen zur Voraussage der Richtung einer Redoxreaktion und zur Be-rechnung der Spannung einer galvanischen Zelle.
U° = e°Kathode - e°Anode
Beispiel: |
Berechnung der Zellspannung (EMK) des Daniell-Elements:
U°(Zn/Cu) = e°(Cu) - e°(Zn) U°(Zn/Cu) = 0,35V - (-0,76V) = 1,11 V
|
Beispiel: |
In welcher Richtung verläuft die Redoxreaktion zwischen den Redoxpaaren Fe2+/Fe3+ und Mn2+/MnO4- ?
Mn2+/MnO4- hat das höhere Standardpotential und wirkt deshalb als Oxidationsmittel. 5Fe2+ + MnO4- + 8H+ |
Elektrodenpotentiale sind temperatur- und konzentrationsabhängig. Die Potentiale und Zellspannungen unter anderen als den Standardbedingungen (25°C, 1013mbar, 1mol/L) lassen sich mit der Nernst'schen Gleichung berechnen.
Eine relativ einfache Form dieser Gleichung ergibt sich, wenn die Temperatur als konstant betrachtet wird (25°C):
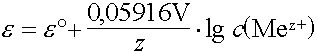 |
Beispiel: |
Welches Elektrodenpotential hat eine Kupferelektrode, die in eine Kupfersulfatlösung mit c = 0,1 mol/L getaucht wird (25°C) ?
|
Für die Berechnung einer Zellspannung werden die nach der Nernst'schen Gleichung korrigierten Potentiale subtrahiert.
U = eKathode - eAnode
Beispiel: |
Wie gross ist die Zellspannung eines Daniell-Elementes wenn c(Cu2+) = 0,1 mol/L und c(Zn2+) = 0,001 mol/L sind (25°C) ?
|
Kombiniert man zwei gleichartige Elemente, bei denen nur die Konzentrationen der Elektrolytlösungen verschieden sind, so entsteht allein aufgrund dieses Konzentrationsunterschiedes eine Potentialdifferenz zwischen den Halbelementen. Ein solches galvanisches Element bezeichnet man als Konzentrationszelle.
Die Elektronen fliessen vom Halbelement mit geringerer Konzentration zum Halbelement mit grösserer Konzentration (grösserer osmotischer Druck), bis sich ein Konzentrationsausgleich eingestellt hat.
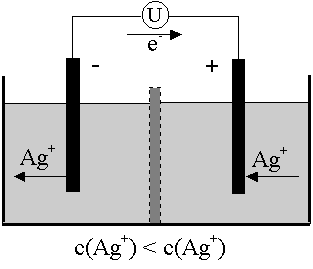
Die Spannung an einer Konzentrationszelle lässt sich ebenfalls mit der Nernst'schen Gleichung berechnen. Da die Standardpotentiale der beiden Halbzellen identisch sind (gleiches Metall), fallen sie aus der Gleichung und es ergibt sich die folgende Beziehung:
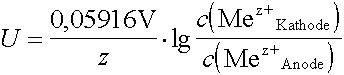
Die Halbzelle mit der jeweils tieferen Konzentration wirkt als Anode, weil dort aufgrund des grösseren Lösungsdruckes resp. kleineren osmotischen Druckes Ionen in Lösung gehen.
Die Potentiometrie beruht nun auf der Messung der Spannung zwischen einer Bezugselektrode mit bekannter und konstanter Elektrolytkonzentration und der Indikatorelektrode, welche aus der zu bestimmenden Ionenlösung und einem für die jeweilige Bestimmung erforderlichen Metall- oder Nichtmetallstab besteht.
Dabei wird willkürlich die Bezugselektrode als Kathode eingesetz. Ist die ihre Konzentration kleiner als diejenige der Indikatorelektrode, ergibt sich eine negative Spannung.
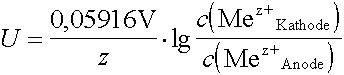 |
Beispiel: |
Zur Bestimmung der Silberionenkonzentration in einer gesättigten, wässrigen Silberchloridlösung taucht man eine Silberelektrode in die Lösung und misst die Spannung zwischen der so gebildeten Halbzelle und einer zweiten Silberelektrode in 0,001 M Silbernitratlösung. Die Spannung beträgt 118 mV. Wie gross ist das Löslichkeitsprodukt von Silberchlorid ?
|
Beispiel: |
Eine Glaselektrode wird in einer Pufferlösung mit pH 7 getaucht und der angeschlossene Potentiometer auf den Nullpunkt gestellt. Dieselbe Elekrode wird nun in eine Säurelösung unbekannter Konzentration gehalten. Es stellt sich am Potentiometer eine Spannung von -210 mV ein. Welchen pH-Wert weist die Säurelösung auf ?
|
Die pH-Änderung ergibt sich direkt, wenn man den Quotienten aus der abgelesenen Spannung und 59 mV bildet. D.h. aus der Spannung ± 59m V ergibt sich eine pH-Wertänderung von ± 1 Einheit.
Taucht man zwei Elektroden in eine Ionen-Lösung oder -Schmelze und legt eine Gleichspannung an, so finden an den Elektroden Reduktions- und Oxidationsvorgänge statt. Diese Vorgänge bezeichnet man als Elektrolyse.
Die negative Elektrode ist ein "Elektronenspender" und damit ein Reduktionsmittel. Sie reduziert die Kationen und wird als Kathode bezeichnet.
Die positive Elektrode ist ein "Elektronensauger" und damit ein Oxidationsmittel. An ihr findet die Oxidation der Anionen statt und sie wird als Anode bezeichnet.
Reduktion und Oxidation laufen gleichzeitig ab. Die bei der Oxidation an der Anode aufgenommenen Elektronen gelangen über die Stromquelle zur Kathode und stehen hier dem Reduktionsvorgang zur Verfügung.
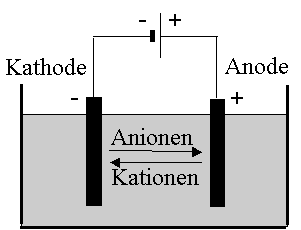
Kathode: |
Reduktion des Na+-Ions zu Na-Metall |
Anode: |
Oxidation des Cl--Ions zu Chlor |
Gesamtreaktion: |
2 NaCl |
Kathode: |
Reduktion von H3O+ zu Wasserstoff |
Anode: |
Oxidation von Wasser zu Sauerstoff |
Gesamtreaktion: |
2 H2O |
Kathode: |
Reduktion von Wasser zu Wasserstoff |
Anode: |
Oxidation von OH- zu Sauerstoff |
Gesamtreaktion: |
2 H2O |
Die Elektrodenvorgänge in einer Elektrolysezelle sind denen in einer galvanischen Zelle entgegengesetzt. Die Zersetzungsspannung, d.h. die Mindestspannung, die zur Elektrolyse erforderlich ist, liegt stets höher als die Zellspannung. Daraus ergibt sich aber trotzdem eine der Spannungsreihe ähnliche Reihe der Entladbarkeit:
K+ |
Na+ |
Mg2+ |
Al3+ |
H+ |
Zn2+ |
Fe2+ |
Ni2+ |
Sn2+ |
Pb2+ |
Cu2+ |
Ag+ |
Au3+ |
schwer entladbar  leicht entladbar
leicht entladbar
Aus wässrigen Lösungen wird somit im Falle von schwer entladbaren Kationen nur Wasserstoff, im Falle von leicht entladbaren Kationen nur Metall und in den übrigen Fällen Wasserstoff und Metall abgeschieden.
Für die wichtigsten Anionen ergibt sich folgende Reihe der Entladbarkeit:
..... |
SO42- |
NO3- |
..... |
OH- |
Cl- |
Br- |
I- |
schwer entladbar  leicht entladbar
leicht entladbar
Damit eine Elektrolyse ablaufen kann, muss elektrische Ladung fliessen. Für den Zusammenhang zwischen geflossener Ladung, Stromstärke und Zeit gilt das 1. Faraday'sche Gesetz:
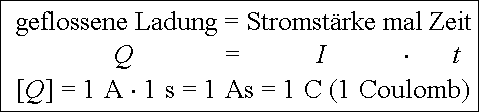
Um 1 Mol eines einfach geladenen Ions abzuscheiden, muss die Ladung von 1 Mol Elektronen fliessen. Die Ladung eines Elektrons beträgt 1,6022·10-19 C oder As. Die Ladung von einem Mol Elektronen ist demnach 6,023·1023 · 1,6022·10-19 C = 96'485 C.
Diesen Sachverhalt drückt das 2. Faraday'sche Gesetz aus:
Um 1/n Mol Ionen der Ladungszahl n zu entladen, muss |
1. |
Ein Gleichstrom von 1,2 A fliesst während 25 min durch eine angesäuerte Nickel(II)-Salzlösung. Wie viele g Nickel werden an der Kathode abgeschieden ? |
Q = I · t = 1,2A·25·60s = 1'800C |
2. |
Ein Gegenstand mit einer Oberfläche von 314 cm2 soll in einem Chrombad (CrO3 in schwach schwefelsaurem Wasser) bei 4,4 A verchromt werden. Der Wirkungsgrad beträgt 18 %. Wie lange dauert die Verchromung, wenn die Schicht 20 µm dick werden soll ? (Dichte von Chrom: 6,92 g/cm3) |
V = 314cm2·0,002cm = 0,628cm3 |
3. |
In einem Wasserzersetzungsapparat sollen 75 mL Knallgas (Nz) hergestellt werden. Wie lange dauert die Zersetzung, wenn ein Strom von 0,8 A durch das angesäuerte Wasser geschickt wird ? h = 98 %. |
3·22,41 L |